Real-Time-PCR-Kit für Affenpockenviren
Produktdetails
Verwendungszweck
Es wird zum Nachweis des Monkeypox-Virus in menschlichen Serum- oder Läsionsexsudatproben mithilfe von Echtzeit-PCR-Systemen verwendet.
Testprinzip
Bei diesem Produkt handelt es sich um ein auf Fluoreszenzsonden basierendes Taqman® Echtzeit-PCR-Assaysystem.Spezifische Primer und Sonden sind für den Nachweis des F3L-Gens des Monkeypox-Virus konzipiert.Interne Kontrollen, die auf das konservierte menschliche Gen abzielen, überwachen die Probenentnahme, die Probenhandhabung und den Echtzeit-PCR-Prozess, um falsch-negative Ergebnisse zu vermeiden.Das Kit ist ein vollständig vorgemischtes lyophilisiertes System, das die für den Monkeypox-Virus-Nachweis erforderlichen Materialien enthält: Nukleinsäureamplifikationsenzym, UDG-Enzym, Reaktionspuffer, spezifischer Primer und Sonde.
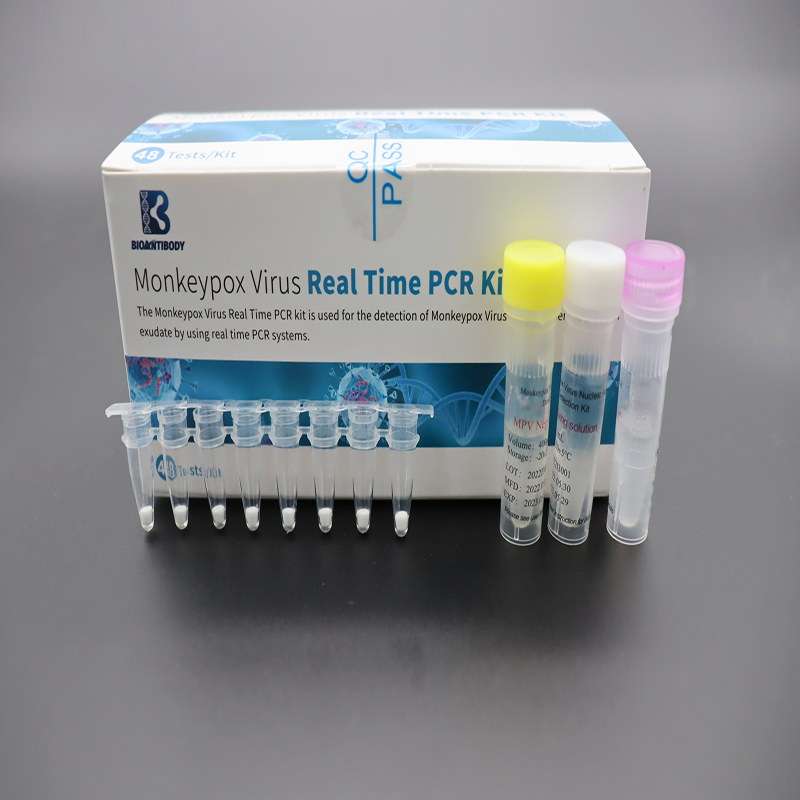
Hauptinhalte
Die mitgelieferten Komponenten sind in der Tabelle aufgeführt.
| Komponenten | Paket | Zutat |
| AffenpockenvirusLyophilisierte Vormischung | PCR-Röhrchen mit 8 Streifen× 6 Beutel | Primer, Sonden, dNTP/dUTP-Mix, Mg2+, Taq-DNA-Polymerase, UDG-Enzym |
| MPV-Positivkontrolle | 400 μL×1 Röhrchen | DNA-Sequenzen, die das Zielgen enthalten |
| MPV-Negativkontrolle | 400 μL×1 Röhrchen | DNA-Sequenzen, die menschliche Gensegmente enthalten |
| Auflösende Lösung | 1 ml×1 Röhrchen | Stabilisator |
| Konformitätsbescheinigung | 1 Stück | / |
Betriebsablauf
1. ProbeSammlung:Die Proben sollten entsprechend in sterilen Röhrchen gesammelt werden
mit standardmäßigen technischen Spezifikationen.
2. Reagenzienvorbereitung (Reagenzienvorbereitungsbereich)
Nehmen Sie die Komponenten des Kits heraus und balancieren Sie sie bei Raumtemperatur aus, um sie im Standby-Modus zu verwenden.
3. Probenverarbeitung (Probenverarbeitungsbereich)
3.1 Nukleinsäureextraktion
Es wird empfohlen, 200 μl flüssige Proben, Positivkontrolle und Negativkontrolle für die Nukleinsäureextraktion gemäß den entsprechenden Anforderungen und Verfahren der viralen DNA-Extraktionskits zu entnehmen.
3.2 Auflösung von lyophilisiertem Pulver und Zugabe von Templat
Bereiten Sie entsprechend der Anzahl der Proben eine lyophilisierte Monkeypox-Virus-Vormischung vor.Für eine Probe ist ein PCR-Röhrchen mit lyophilisiertem Vormischungspulver erforderlich.Negativkontrolle und Positivkontrolle sollten als zwei Proben behandelt werden.
(1) 15 μl Lösungslösung in jedes PCR-Röhrchen mit lyophilisierter Vormischung geben, dann jeweils 5 μl extrahierte Proben/Negativkontrolle/Positivkontrolle in jedes PCR-Röhrchen geben.
(2) PCR-Röhrchen fest abdecken, PCR-Röhrchen von Hand bewegen, bis das lyophilisierte Pulver vollständig aufgelöst und vermischt ist, und die Flüssigkeit durch sofortige Zentrifugation bei niedriger Geschwindigkeit am Boden der PCR-Röhrchen sammeln.
(3) Wenn Sie zum Nachweis ein herkömmliches Echtzeit-PCR-Instrument verwenden, übertragen Sie die PCR-Röhrchen direkt in den Amplifikationsbereich.Wenn Sie BTK-8 zum Nachweis verwenden, müssen Sie die folgenden Vorgänge durchführen: 10 μL Flüssigkeit aus dem PCR-Röhrchen in die Vertiefung des Reaktionschips von BTK-8 übertragen.Ein PCR-Röhrchen entspricht einer Vertiefung auf dem Chip.Stellen Sie beim Pipettieren sicher, dass die Pipette im 90-Grad-Winkel steht.Die Pipettenspitzen mit Aerosolbarriere sollten mit mäßiger Kraft in der Mitte der Vertiefung platziert werden und aufhören, die Pipette zu schieben, wenn sie den ersten Gang erreicht (um Blasen zu vermeiden).Nachdem die Vertiefungen gefüllt sind, nehmen Sie eine Reaktionschip-Membran heraus, um alle Vertiefungen abzudecken, und der Chip wird dann in den Amplifikationserkennungsbereich übertragen.
4. PCR-Amplifikation (Detektionsbereich)
4.1 Geben Sie die PCR-Röhrchen/den Reaktionschip in den Reaktionstank und geben Sie die Namen der einzelnen Reaktionsvertiefungen in der entsprechenden Reihenfolge ein.
4.2 Einstellungen der Detektionsfluoreszenz: (1) Monkeypox-Virus (FAM);(2) Interne Kontrolle (CY5).
4.3 Führen Sie das folgende Fahrradprotokoll aus
Protokoll von ABI7500, Bio-Rad CFX96, SLAN-96S, QuantStudio:
| Schritte | Temperatur | Zeit | Fahrräder | |
| 1 | Vordenaturierung | 95℃ | 2 Minuten | 1 |
| 2 | Denaturierung | 95℃ | 10 s | 45 |
| Annealing, Extension, Fluoreszenzerfassung | 60℃ | 30 s | ||
Protokoll von BTK-8:
| Schritte | Temperatur | Zeit | Fahrräder | |
| 1 | Vordenaturierung | 95℃ | 2 Minuten | 1 |
| 2 | Denaturierung | 95℃ | 5 s | 45 |
| Annealing, Extension, Fluoreszenzerfassung | 60℃ | 14 s | ||
5. Ergebnisanalyse (siehe Benutzerhandbuch des Instruments)
Nach der Reaktion werden die Ergebnisse automatisch gespeichert.Klicken Sie zum Analysieren auf „Analysieren“ und das Instrument interpretiert automatisch die Ct-Werte jeder Probe in der Ergebnisspalte.Die Ergebnisse der Negativ- und Positivkontrolle müssen der folgenden „6. Qualitätskontrolle“ entsprechen.
6. Qualitätskontrolle
6.1 Negativkontrolle: Kein Ct oder Ct>40 im FAM-Kanal, Ct≤40 im CY5-Kanal mit normaler Amplifikationskurve.
6.2 Positivkontrolle: Ct≤35 im FAM-Kanal mit normaler Amplifikationskurve, Ct≤40 im CY5-Kanal mit normaler Amplifikationskurve.
6.3 Das Ergebnis ist gültig, wenn alle oben genannten Kriterien erfüllt sind.Andernfalls ist das Ergebnis ungültig.
Ergebnisinterpretation
Folgende Ergebnisse sind möglich:
| Ct-Wert des FAM-Kanals | Ct-Wert des CY5-Kanals | Deutung | |
| 1# | Kein Ct oder Ct>40 | ≤40 | Affenpockenvirus negativ |
| 2# | ≤40 | Irgendwelche Ergebnisse | Affepockenvirus positiv |
| 3# | 40~45 | ≤40 | Erneut testen;Wenn es immer noch 40–45 ist, melden Sie es als 1# |
| 4# | Kein Ct oder Ct>40 | Kein Ct oder Ct>40 | Ungültig |
NOTIZ: Wenn ein ungültiges Ergebnis auftritt, muss die Probe entnommen und erneut getestet werden.
Bestellinformationen
| Produktname | Katze.NEIN | Größe | Probe | Haltbarkeit | Trans.& Sto.Temp. |
| Real-Time-PCR-Kit für Affenpockenviren | B001P-01 | 48 Tests/Kit | Serum/Läsionsexsudat | 12 Monate | -25~-15℃ |